О направлении
Гомеостаз в физиологии - это постоянство состава и свойств внутренней среды и устойчивость основных физиологических функций организма человека, животных и растений, несмотря на значительные изменения внешних условий.
Одним из основных направлений в работе коллектива является системный анализ механизмов клеточного гомеостаза. Мы используем современные методы системной биологии для того, чтобы количественно охарактеризовать гомеостаз изучаемых систем и попытаться понять молекулярные механизмы, обеспечивающие стабилизацию в организме различных параметров метаболизма. В этом направлении используется как математическое моделирование метаболических систем, так и экспериментальные исследования регуляции метаболизма в клетках млекопитающих. Использование фундаментальных представлений о гомеостазе позволяет создавать новые подходы в терапии и диагностики многих заболеваний, откуда вытекают прикладные исследования лаборатории.
Исследования идут по четырем направлениям:
• Фундаментальные:
1) исследования гомеостаза в разных метаболических системах ;
2) исследования взаимодействия физиологических систем на примере взаимодействия свертывающей системы крови и системы комплемента;
• Прикладные:
3) создание эритроцитов-биореакторов и эритроцитов-носителей фармпрепаратов
4) исследование влияния эритроцитов на микрореологию крови
Основные достижения работы лаборатории:
1. Исследования гомеостаза в разных метаболических системах
Одним из основных объектов исследования в этой работе является эритроцит человека - наиболее просто устроенная клетка. В ходе работы с эритроцитами впервые был выяснен механизм стабилизации концентрации АТФ в этих клетках [1] (Рисунок 1), изучен механизм регуляции пентозофосфатного пути [2], исследованы механизмы стабилизации клеточного объема [3], была выдвинута новая гипотеза о роли двух противоположных трансмембранных градиентов ионов (Na+ и K+) в клетках [4]. Были созданы математические модели отдельных метаболических систем эритроцита, которые позволили описать связь метаболических процессов с жизнеспособностью эритроцитов в организме и объяснить механизмы гибели этих клеток при дефицитах различных ферментов гликолиза и гемолитических анемиях [5]. Все эти исследования позволили охарактеризовать гомеостаз эритроцита по отношению к основным возмущающим воздействиям на эту клетку. Стало ясно, что главная цель гомеостаза эритроцита – стабилизация отношения объема этой клетки к площади ее мембраны – главный для организма показатель, критически важный для обеспечения оптимальной реологии эритроцита в капиллярной сети организма.
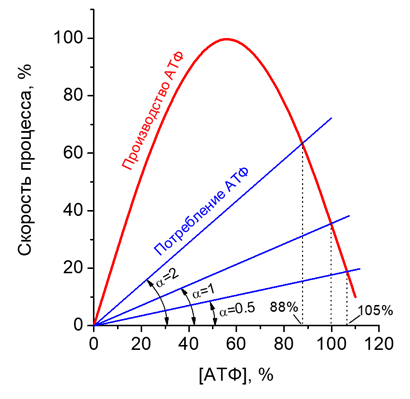
Рисунок 1. Механизм стабилизации концентрации АТФ в эритроцитах. Наши исследования показали, что зависимость скорости производства АТФ от его концентрации (красная линия) в эритроцитах имеет колоколообразный вид с круто падающим участком в области физиологически нормальных значений концентрации АТФ. Такой вид этой зависимости позволяет обеспечить стабилизацию уровня АТФ при изменении в клетке активности АТФ-потребляющих процессов (синие линии).
В настоящее время мы завершаем создание полной математической модели эритроцита - «эритроцита in silico» - системно-биологической модели этой клетки, которая должна вести себя количественно аналогично реальному эритроциту во всех имитациях внешних воздействий на эту клетку и при всех генетических изменениях ее состава. Помимо исследования фундаментальных механизмов клеточного гомеостаза в эритроцитах, в коллективе ведется исследование регуляции метаболических процессов в печени и мышцах.
Исследование регуляции метаболизма метионина в печени показало, что этот метаболизм резко переключается из режима сохранения метионина в клетках при его нормальной концентрации в режим удаление (утилизации) метионина при увеличении его концентрации [6]. Математическое моделирование метаболизма фолатов в печени показало, что этот метаболизм обеспечивает независимое функционирование сопряженных с ним метаболических систем, таких как синтез пуринов, синтез дезокситимидинмонофосфата, катаболизм гистидина, метаболизм муравьиной кислоты и метаболизм метионина [7] .
Активно ведутся исследования в области взаимоотношения гормональной регуляции энергетических процессов в мышце с внутриклеточными механизмами регуляции производства и потребления энергии в мышечных клетках. Предварительные данные показывают, что активация гликогенолиза в мышцах, вызываемая выбросом адреналина в условиях стресса, может приводить к увеличению максимальной скорости производства АТФ в гликолизе в 40 раз по сравнению с состоянием покоя. При этом также увеличивается эффективность стабилизации уровня АТФ. Схема взаимодействия гликолиза и метаболизма гликогена при активации мышечной нагрузки представлена на Рисунке 2.
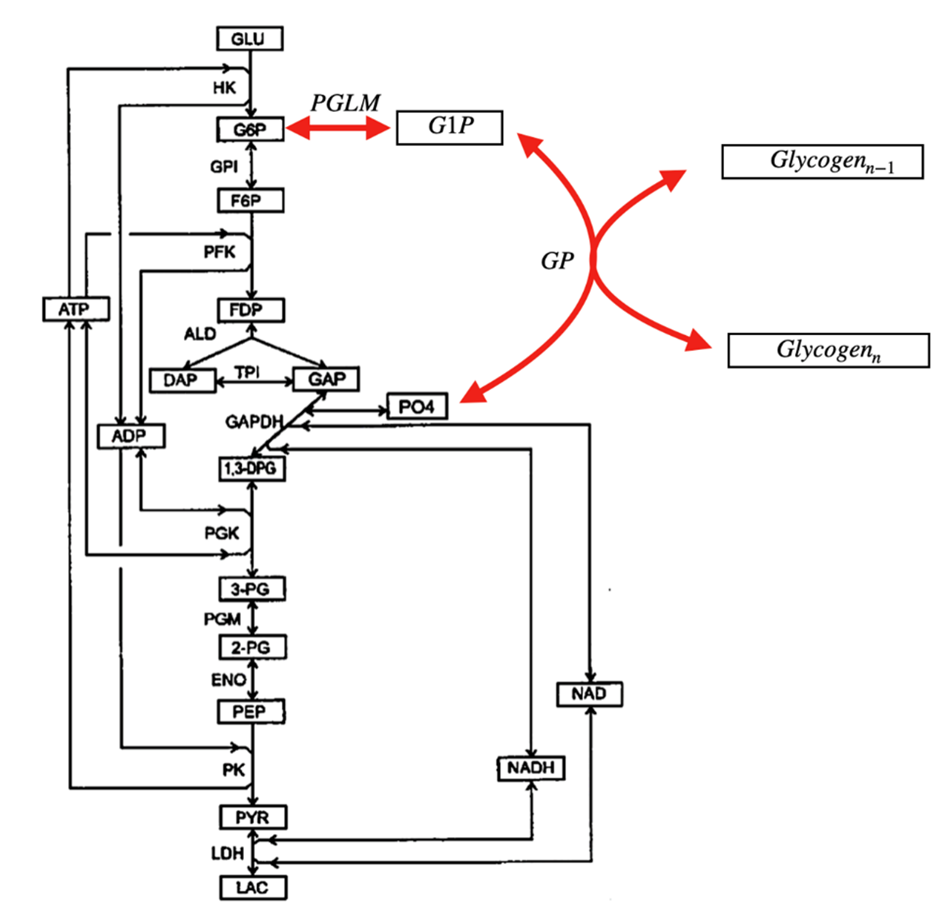
Рисунок 2. Связь гликолиза и метаболизма гликогена при активации мышечной нагрузки. Красными стрелками показаны реакции метаболизма гликогена. GP – гликогенфосфорилаза, PGLM – фосфоглюкомутаза.
2. Системный анализ связи гемостаза и воспаления. КОВИД-19.
Одна из наших исследовательских групп занимается изучением взаимодействия системы гемостаза и воспаления.
Сегодня эта тема активнейшим образом развивается большим количеством ученых во всем мире. Ожидается, что исследования в этой области могут иметь большое значение для разработки новых методов лечения тяжелобольных с сильным воспалением – сепсисом. Эти разработки могут помочь огромному числу людей по всему миру: по данным Всемирной организации здравоохранения сепсис ежегодно развивается более чем у 30 миллионов человек и, возможно, уносит жизни 6 миллионов человек. Ежегодно около 3 миллионов новорожденных страдает от сепсиса. Уже давно известно, что из-за тяжелого инфекционного заболевания или массивной травмы у пациентов могут наблюдаться нарушения свертывания крови, которые могут проявляться в виде тромбозов или кровотечений, что может значительно осложнить течение болезни и даже привести к смерти пациента. В норме, когда у человека нет никаких инфекций и крупных травм, система гемостаза предотвращает потерю крови из небольших ран: в месте повреждения образуется сгусток – тромб, закрывающий место повреждения и блокирующий ток крови. Для организма это жизненно необходимо, поскольку в противном случае из раны вытечет вся кровь, необходимая для переноса кислорода. Таким образом, при повреждении стенок кровеносных сосудов, гемостаз сначала должен сформировать достаточно крепкий сгусток в месте повреждения, а затем, как только этот сгусток закроет всю рану, гемостаз должен выключится – иначе вся кровь в организме может превратиться в один большой тромб, неспособный транспортировать кислород к органам. Однако при сепсисе баланс активации-торможения свертывания может смещаться к какую-то из двух сторон, что будет способствовать развитию тромбозов или кровотечений у тяжелобольного пациента. Образование тромба в неположенном месте из-за гиперактивности гемостаза заблокирует ток крови к жизненно важным органам и может привести к их отмиранию, а кровотечение приведет к уменьшению циркулирующего объема крови, что также скажется на эффективности транспорта кислорода к органам. Разбалансировка работы гемостаза является существенной угрозой жизни пациента.
Проблема состоит в том, что стандартные методы анализа гемостаза довольно плохо предсказывают тромбозы и кровотечения – обычно, если клинические тесты указывают на нарушения свертывания, то делать что-либо поздно, поскольку у таких пациентов, с большой вероятностью, эти осложнения уже могут присутствовать. Поэтому крайне важно оценивать динамику развития воспалительных процессов у пациентов, понимать какие медиаторы воспаления играют ключевую роль в разбалансировке гемостаза и каким образом они это делают. Задача эта весьма сложная, поскольку число медиаторов воспаления огромно, эффект каждого из них на гемостаз плохо изучен, часто его нельзя определить однозначно, а совокупное влияние медиаторов на гемостаз может быть непредсказуемым. Однако решая эту задачу с использованием теоретических и экспериментальных методов, мы можем выделить основные медиаторы воспаления, влияющие на свертывание крови и разработать новые предсказательные модели.
Наша команда занимается изучением влияния комплемента – важного элемента системы иммунитета, активация которого наблюдается при сепсисе – на свертывание крови. Мы занимаемся построением теоретических и экспериментальных моделей взаимодействия системы комплемента и гемостаза. Эти модели могут быть использованы для разработки новых методов лечения пациентов с сепсисом и создания новых лекарственных средств. . Схема взаимодействия гемостаза и комплемента представлена на Рисунке 3.
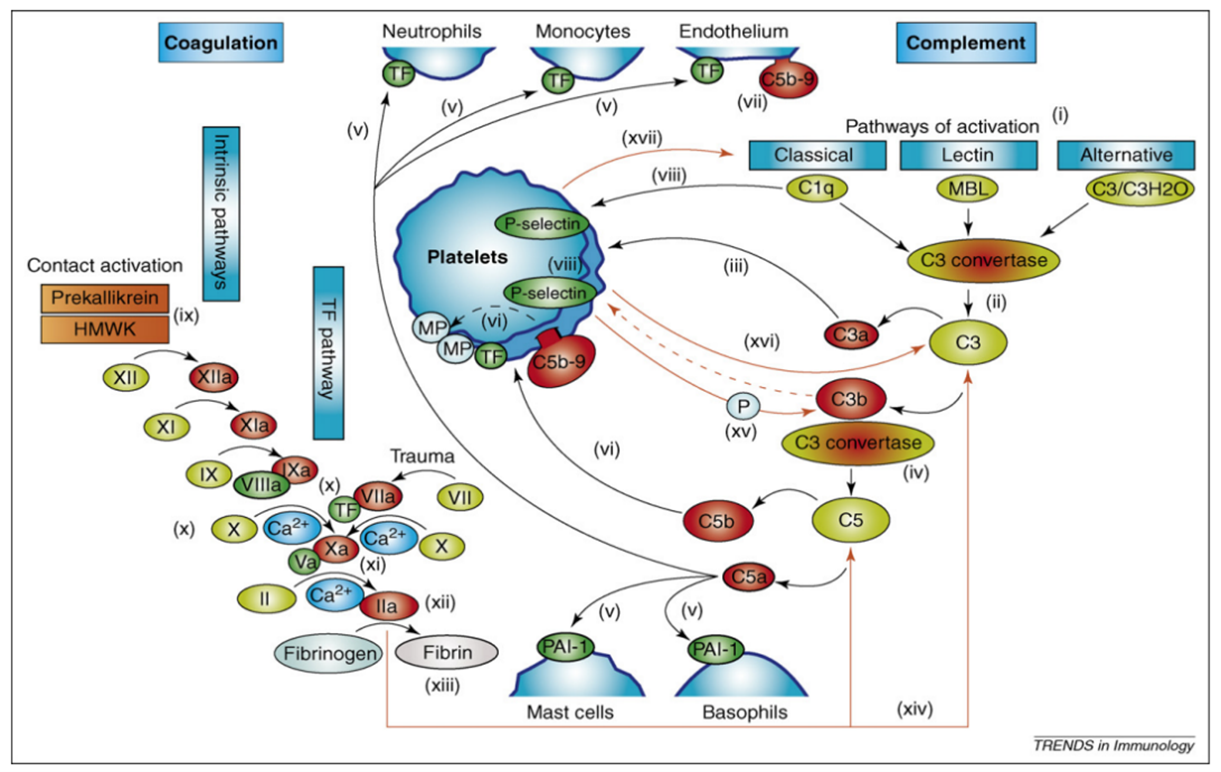
Рисунок 3. Взаимодействие систем гемостаза и комплемента [8]
Эта пандемия стала тяжелым испытанием для систем здравоохранения по всему миру в том числе и из-за существенных нарушений гемостаза, возникающих у тяжелобольных при заражении COVID-19. У таких пациентов имелись значительные риски тромботических осложнений, превышающие таковые при других инфекционных заболеваниях. Тромботические осложнения утяжеляли ход болезни, осложняли лечение, а риски неблагоприятного исхода при их развитии серьезно возрастали.
Нам удалось показать, с использованием глобального теста плазменного гемостаза «Тромбодинамика» , что у 75% поступающих в больницу пациентов фиксируются нарушения гемостаза со сдвигом в сторону тромбообразования. В процессе лечения у большого количества пациентов гемостаз нормализуется, но сохраняется группа пациентов, у которых, несмотря на проводимое лечение, могут наблюдаться эпизоды спонтанной «плазменной гиперкоагуляции», во время которых возникают тромботические осложнения.
Исследователями по всему миру обнаружено большое количество факторов, которые гипотетически могли бы приводить к гиперкоагуляции при коронавирусной инфекции [9], но ни один из них не может рассматриваться в качестве основного и не могут быть использованы для выявления группы пациентов с риском развития гиперкоагуляционного состояния. В настоящее время четкого понимания причин возникновения эпизодов спонтанной гиперкоагуляции нет.
Пандемия COVID-19 выявила острую потребность в разработке новых методов оценки состояния свертывания и исследования прогностической способности новых маркеров, в том числе маркеров воспаления. Их разработка, которая ведется в том числе нашей командой, приведет к более качественному лечению пациентов не только при COVID-19, но и при других инфекционных заболеваниях, поскольку мы будем иметь более глубокое представление о взаимодействии систем организма при инфекционных заболеваниях. Рисунок 4 показывает, что пациенты с эпизодами спонтанной гиперкоагуляции чаще страдали от тромботических осложнений и их госпитализация чаще оканчивалась летальным исходом.
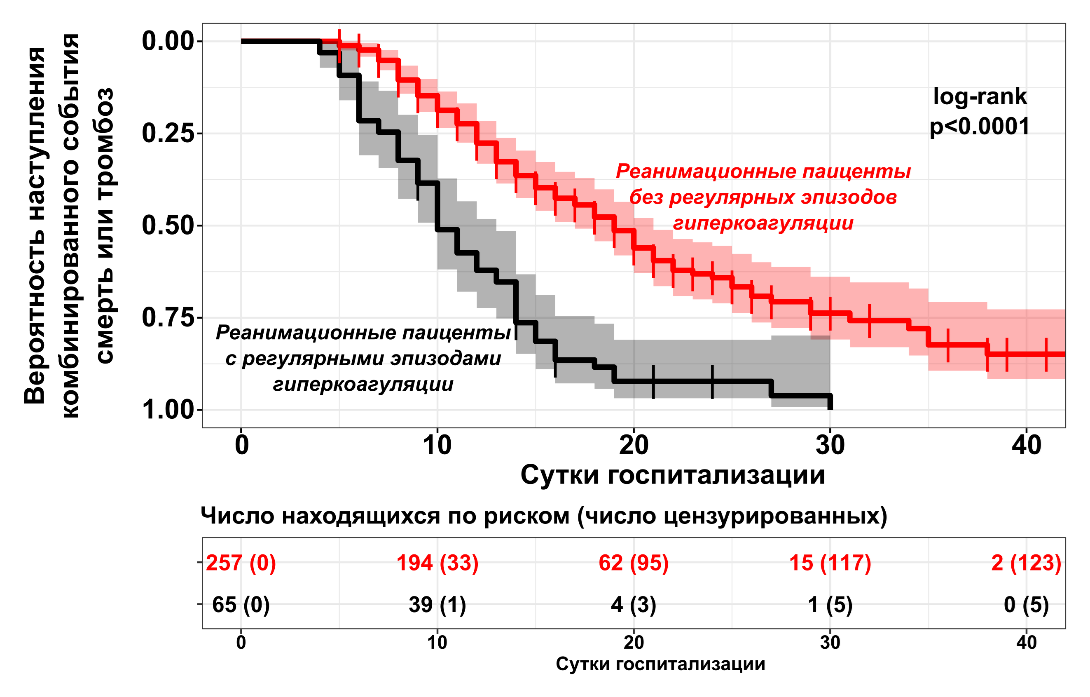
Рисунок 4. Риски развития тромботического осложнения и/или летального исхода у реанимационных пациентов с и без регулярных эпизодов спонтанной гиперкоагуляции при коронавирусной инфекции
3. Эритроциты - носители лекарственных препаратов
Современная фармакология разрабатывает не только новые лекарственные вещества, но и новые формы уже существующих лекарств, которые должны обладать преимуществами по сравнению с традиционными формами этих препаратов. Одним из таких подходов является использование эритроцитов, как носителей лекарственных веществ. Такие эритроциты (фармакоциты) , могут обладать целым рядом преимуществ, основными из которых являются отсутствие аллергических реакций на препарат, т.к. он спрятан внутри собственных клеток организма, увеличение времени жизни препарата в кровотоке за счет отсутствия реакций с присутствующими в крови антителами и протеазами, а также снижение токсического действия лекарства, т.к. при его введении отсутствуют высокие пиковые дозы препарата в плазме крови. Особенно выигрышным оказывается включение в эритроциты ферментных лекарственных препаратов. При этом фермент может длительно работать внутри клетки при условии, что субстраты и продукты его реакции легко проникают через мембрану эритроцита. Это так называемые эритроциты-биореакторы (ЭБР) . При включении в эритроцит некоторых низкомолекулярных лекарственных соединений можно получить депо-формы данных препаратов в крови, т.к. лекарство постепенно освобождается из эритроцитов, поддерживая в плазме свою терапевтическую концентрацию. Еще одной функцией фармакоцитов может являться направленная доставка лекарственного препарата в определенные органы и ткани. В эритроциты могут быть включены самые различные биологически активные компоненты (Рисунок 5).
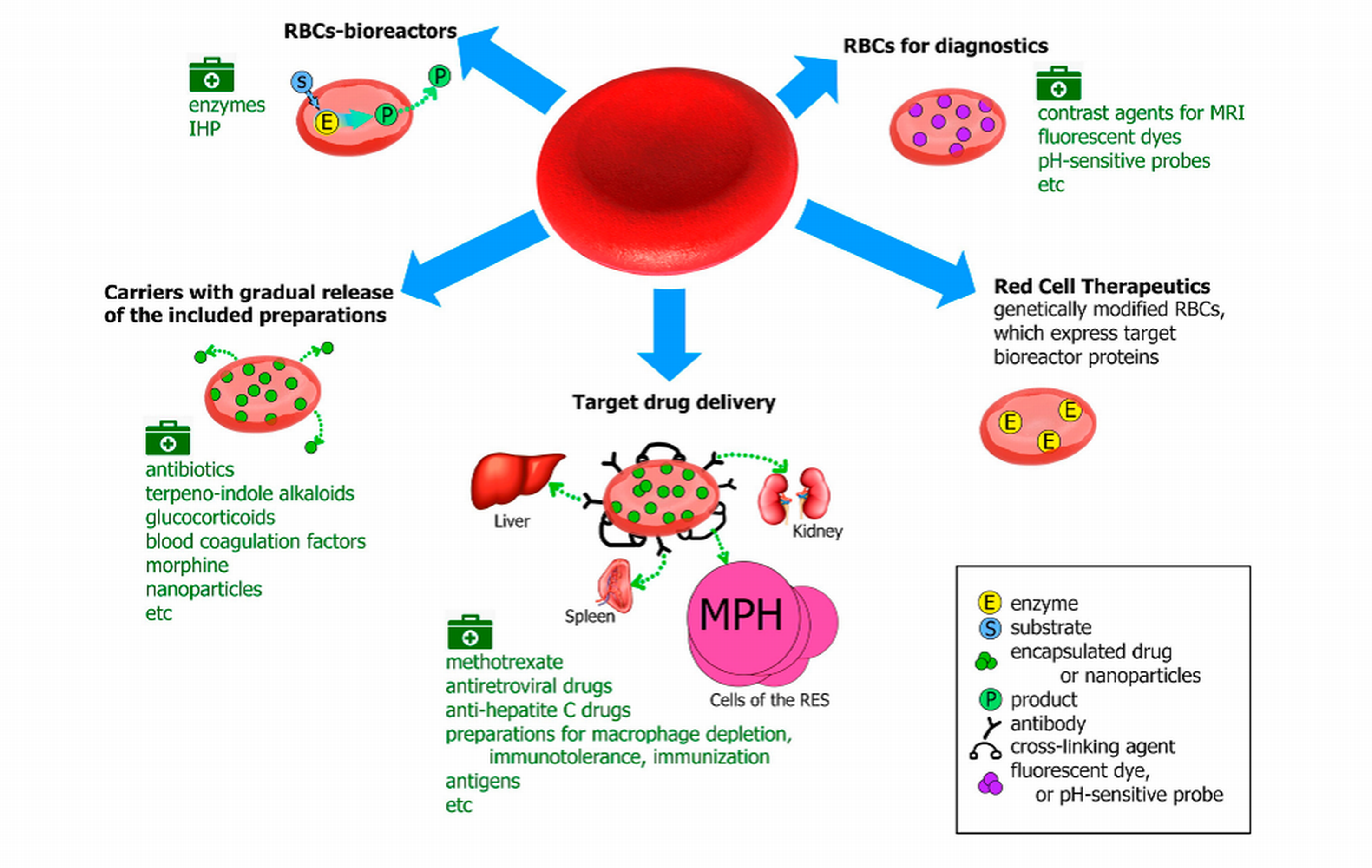
Рисунок 5. Возможные способы использования эритроцитов, загруженных биологически активными соединениями и наночастицами. MRI – изображения магнитного резонанса, IHP – инозитолгексафосфат, MPH - макрофаги, RES – ретикулоэндотелиальная система.
В лаборатории ведутся работы по нескольким направлениям, связанным с фармакоцитами:
А. Создание различных ЭБР, а также эритроцитов-носителей низкомолекулярных лекарственных препаратов и исследование их свойств.
Б. Создание автоматической установки для включения биологически активных препаратов в эритроциты методом проточного диализа, и определение оптимальных параметров этого метода.
В. Теоретическое исследование функционирования ЭБР. Создание математических моделей ЭБР с целью выявления ограничений в их работе.
Основные достижения в работе группы:
А. Были разработаны и исследованы эритроциты-переносчики противоопухолевых препаратов: аспарагиназы [10-13] и антрациклиновых антибиотиков [14-21], а также противовоспалительного агента дексаметазон-21-фосфата. В эритроциты был включен также фактор системы свертывания крови IX [22,23] и ферментный комплекс люциферин-люцифераза (для измерения уровня АТФ в эритроцитах [24]). Терапевтическая эффективность и пониженная токсичность эритроцитов, нагруженных антрациклиновыми антибиотиками была продемонстрирована в клинических экспериментах [14,15,25,26]. Также были разработаны эритроциты-биореакторы, нагруженные ферментами, позволяющими удалять из кровотока алкоголь [27] и аммоний [28,29].
Разработан первый отечественный препарат аспарагиназы в эритроцитах (АСПЭР) для клинического применения при лечении острого лимфобластного лейкоза. Начаты пилотные испытания по исследованию его безопасности, фармакокинетики и фармакодинамики. Препарат показал себя как безопасный. Длительность снижения концентрации аспарагина в плазме возрастала при увеличении дозы аспарагиназы, полученной пациентом в эритроцитах.
Впервые разработаны новые ЭБР для удаления из крови аммония, которые содержат одновременно два фермента: глутаматдегидрогеназу (GDH) и аланинаминотрансферазу (ААТ). Такие аммоциты были получены экспериментально. Скорость утилизации аммония этими ЭБР in vitro составила примерно 1,5 ммоль/час×лЭБР, а in vivo в модели гипераммониемии у мышей - 2.0 ммоль/час×лЭБР [28].
Б. Создана и запатентована автоматическая установка для включения биологически активных соединений в эритроциты этим методом (Рисунок 6) [30,31].
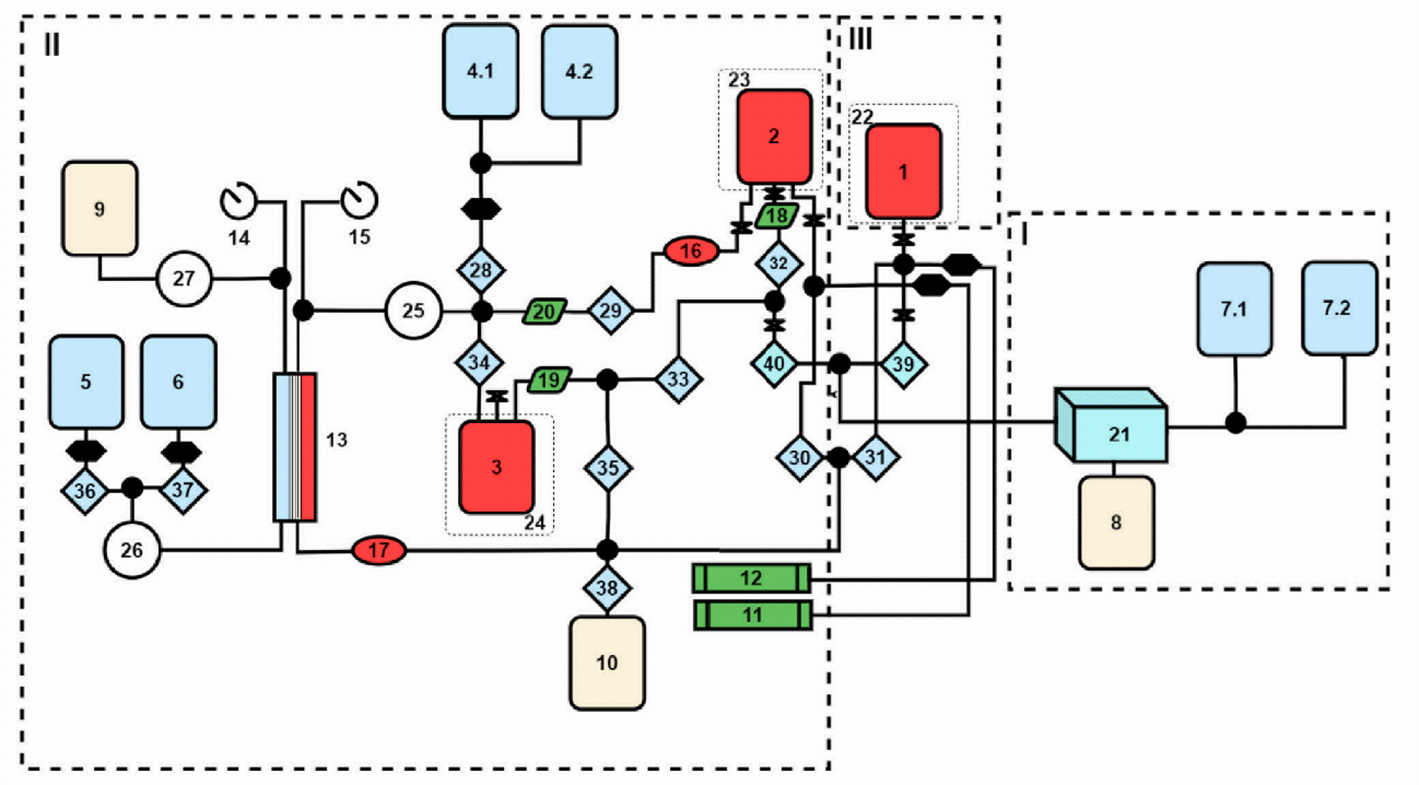
Рисунок 6. Схема автоматического устройства для получения фармакоцитов методом проточного диализа, где: (1-10) – мешки для компонентов крови и растворов; (11, 12) – шприцевые насосы для добавления лекарственного вещества и гиперосмотического запечатывающего раствора, соответственно; (13) – диализатор; (14, 15) – датчики давления на внешнем и внутреннем контурах диализатора; (16, 17) - датчики гематокрита; (18-20) – датчики наличия жидкости в магистрали; (21) – отмывающее клетки устройство; (22-24) – перемешивающие устройства (шейкеры); (25-27) – перистальтические насосы; (28-40) –клапаны, пережимающие магистрали; I, II, III – блоки отмывки, диализа и инкубации, соответственно, с поддержанием температуры 20-25 оС, 4-8 оС и 35-40 оС, соответственно
Сравнение данной установки и других существующих запатентованных устройств показало, что эффективность включения препаратов в эритроциты с помощью данной установки превосходит результаты работы всех других устройств.
Группой разработана стерильная процедура включения L-аспарагиназы методом проточного диализа.

Внешний вид установки для стерильного включения L-аспарагиназы в эритроциты
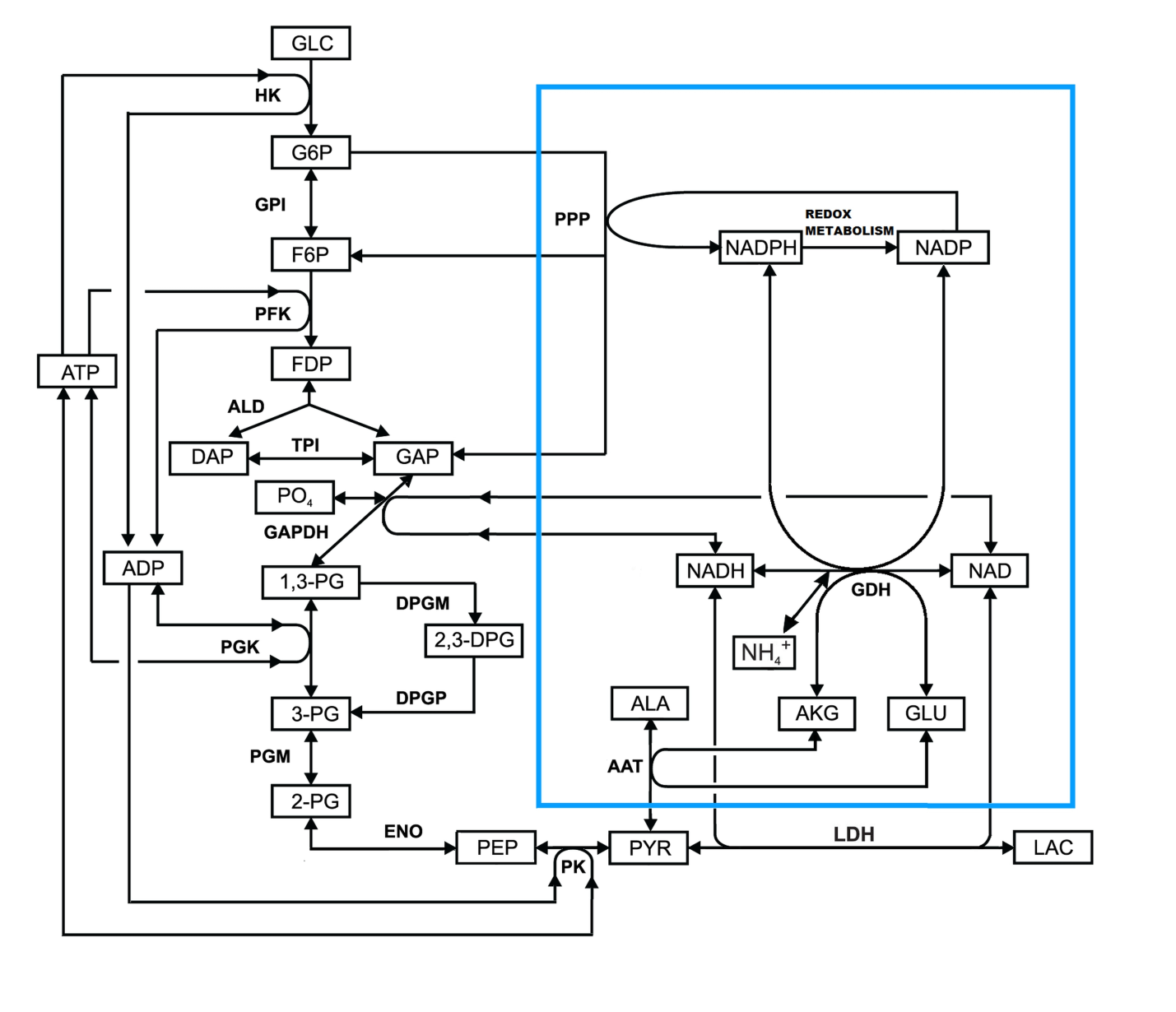
Рисунок 7. Реакции гликолиза и включенных в эритроциты GDH и ААТ (в голубой рамке) в аммоцитах. AKG – α-кетоглутарат, GLU – глутамат, PYR – пируват, ALA – аланин
4. Исследование влияния эритроцитов на микрореологию крови
Еще одним направлением прикладных исследований является изучение реологии эритроцитов в капиллярах. Основной функцией эритроцитов является осуществление газообмена с тканями. Поскольку диаметр капилляров микроциркуляции в организме сравним с размерами эритроцитов, первостепенное значение в продвижении эритроцитов по капиллярам приобретает их способность изменять форму под действием внешних сил (деформируемость). Как показали исследования гомеостаза эритроцитов в организме, это один из главных показателей их состояния. Исследователи хорошо понимают роль деформируемости в выживании эритроцитов в кровотоке, поэтому существует целый ряд методов для ее оценки. «Золотым стандартом» на сегодняшний день считается метод эктацитометрии, который анализирует диффракционную картину, получаемую в суспензии изучаемых клеток при разных величинах приложенного сдвигового напряжения. Однако наличие малой доли дефектных клеток никак не отражается на показаниях эктацитометрии, которая измеряет усредненные параметры эритроцитов во всей популяции, т.к. в этом методе суспензия клеток течет по широкому каналу. Деформируемость эритроцитов слабо влияет на макрореологию крови, но оказывается очень важна для ее микрореологии. Даже малая доля клеток, неспособных проходить по капиллярам, сильно влияет на микрореологию крови, т.к. каждая такая клетка может полностью закрыть доступ крови в капилляр (Рисунок 8).
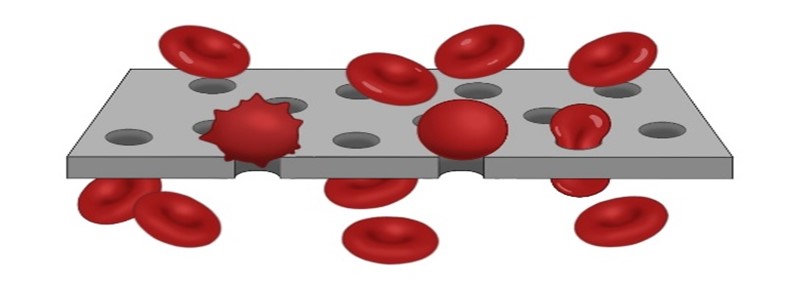
Рисунок 8. Прохождение эритроцитов через поры фильтра. Эритроциты с нормальной способностью деформироваться (имеющие форму двояковогнутого диска) проходят поры без затруднений, в то время как эритроциты с нарушенными физическими свойствами (например, увеличенные в объеме клетки и т.д.) закупоривают поры.
Наша группа занимается исследованием фильтруемости эритроцитов при различных патологиях, в том числе при COVID-19, а также для оценки качества получаемых фармакоцитов. Для измерения мы использовали запатентованный ранее прибор ИДА-01 [37]. Важной особенностью метода измерения фильтруемости является его высокая чувствительность к присутствию в суспензии исследуемых эритроцитов даже очень незначительной доли плохо фильтрующихся клеток. Поскольку количество пор на мембране, через которую фильтруются эритроциты, более чем на порядок величины меньше, чем количество проходящих через нее клеток, плохо фильтрующиеся клетки постепенно забивают поры фильтра, снижая общую скорость фильтрации. Это позволяет обнаружить даже небольшие количества эритроцитов с низкой способностью к деформации.
С помощью измерения фильтруемости эритроцитов мы исследовали влияние COVID-19 на эритроциты пациентов и обнаружили, что с ухудшением состояния пациента фильтруемость его эритроцитов снижается. Оказалось, что фильтруемость эритроцитов может быть использована для предсказания исхода заболевания при COVID-19 (Рисунок 9). Чем ниже падает фильтруемость, тем выше вероятность летального исхода. При F≤0.65 все 100% исходов были летальные.
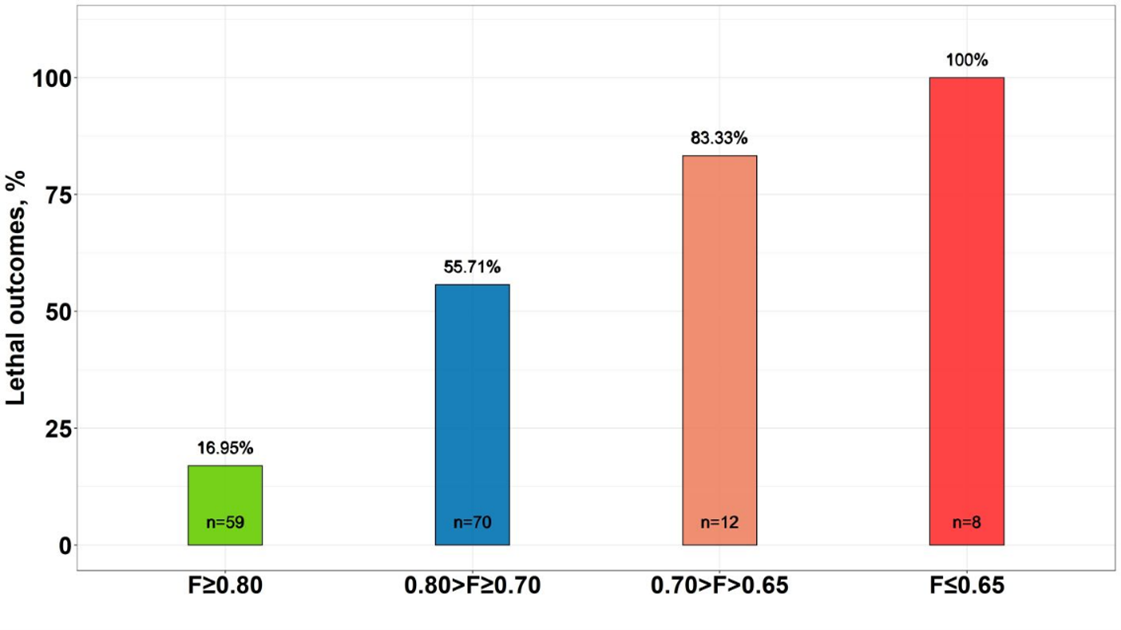
Рисунок 9. Процент летальных исходов при COVID-19 в группах пациентов с различной фильтруемостью эритроцитов.
Таким образом, разработка прикладных направлений дает дополнительный материал для развития фундаментальных исследований, что, в свою очередь, позволяет существенно повысить эффективность прикладных исследований [27-29,32,33].
Кроме описанных направлений работы, члены коллектива активно сотрудничают с лабораторией проф. Р. Банерджи в Университете Мичигана, Анн Арбор, США в исследованиях влияния сероводорода (одного из газообразных сигнальных метаболитов) на метаболизм в клетках человека [38-40].
Список цитированных публикаций
[1] Ataullakhanov F.I., Vitvitsky V.M., Zhabotinsky A.M., Pichugin A.V., Platonova O.V., Kholodenko B.N., Ehrlich L.I. The regulation of glycolysis in human erythrocytes. The dependence of the glycolytic flux on the ATP concentration. Eur. J. Biochem. 1981;115:359–365. https://doi.org/10.1111/j.1432-1033.1981.tb05246.x.[2] Атауллаханов Ф.И., Жаботинский А.М., Пичугин А.В., Толокнова Н.Ф. Зависимость скорости функционирования пентозного пути в эритроцитах от степени восстановлености глютатиона. Биохимия 1981;46:530–41.
[3] Martinov M.V., Vitvitsky V.M., Ataullakhanov F.I. Volume stabilization in human erythrocytes: Combined effects of Ca2+-dependent potassium channels and adenylate metabolism. Biophys. Chem. 1999;80:199–215. https://doi.org/10.1016/S0301-4622(99)00079-4.
[4] Ataullakhanov F.I., Martinov M.V., Shi Q., Vitvitsky V.M. Significance of two transmembrane ion gradients for human erythrocyte volume stabilization. PLoS One 2022;17:e0272675. https://doi.org/10.1371/journal.pone.0272675.
[5] Martinov M.V, Plotnikov A.G., Vitvitsky V.M., Ataullakhanov F.I. Deficiencies of glycolytic enzymes as a possible cause of hemolytic anemia. Biochim. Biophys. Acta – Gen. Subj. 2000;1474:75–87. https://doi.org/10.1016/S0304-4165(99)00218-4.
[6] Martinov M.V., Vitvitsky V.M., Banerjee R., Ataullakhanov F.I. The logic of the hepatic methionine metabolic cycle. Biochim. Biophys. Acta - Proteins Proteomics 2010;1804:89–96. https://doi.org/10.1016/j.bbapap.2009.10.004.
[7] Zaitsev A.V., Martinov M.V., Vitvitsky V.M., Ataullakhanov F.I. Rat liver folate metabolism can provide an independent functioning of associated metabolic pathways. Sci. Rep. 2019;9:7657. https://doi.org/10.1038/s41598-019-44009-5.
[9] Conway E.M., Mackman N., Warren R.Q., Wolberg A.S., Mosnier L.O., Campbell R.A., Gralinski L.E., Rondina M.T., van de Veerdonk F.L., Hoffmeister K.M., Griffin J.H., Nugent D, Moon K, Morrissey J.H. Understanding COVID-19-associated coagulopathy. Nat Rev Immunol. 2022; 22(10):639-649. doi: 10.1038/s41577-022-00762-9
[10] Борсакова Д.В., Плахотник М.Е., Колева Л.Д., Бовт Е.А., Александрович Ю.Г., Синауридзе Е.И., Атауллаханов Ф.И. Сравнительные методологические исследования включения L-аспарагиназы в эритроциты. Онкогематология 2018;13:91–101.
[11] Sinauridze E.I., Vitvitsky V.M., Pichugin A.V., Zhabotinsky A.M., Ataullakhanov F.I. A new chemotherapeutic agent: L‐asparaginase entrapped in red blood cells. Adv. Exp. Med. Biol. 1992; 326:203–206. doi:10.1007/978‐1‐4615‐3030‐5_25.
[12] Синауридзе Е.И.. Способ получения эритроцитов, заполненных лекарственным веществом. Авторское свидетельство СССР, № 1469609, 1 декабря 1988 г. (заявка № 416064/28-12 173058 от 15.12.1986г., класс СО1 33/48).
[13] Аграненко В.А., Атауллаханов Ф.И., Витвицкий В.М., Кияткин А.Б., Жаботинский А.М., Маркова Н.А., Синауридзе Е.И.. Способ консервирования фармакоцитов с включенной L-аспарагиназой. Авторское свидетельство СССР № 1777887, 1 августа 1992 г. (заявка № 4856882 от 24 августа 1990 г., класс А61К 47/00).
[14] Skorokhod O.A., Garmaeva T.T., Vitvitsky V.M., Isaev V.G., Parovichnikova E.N., Savchenko V.G., Ataullakhanov F.I. Pharmacokinetics of erythrocyte-bound daunorubicin in patients with acute leukemia. Med. Sci. Monit. 2004;10:PI55-64.
[15] Skorokhod O.A., Kulikova E.V., Galkina N.M., Medvedev P.V., Zybunova E.E., Vitvitsky V.M., Pivnik A.V., Ataullakhanov F.I. Doxorubicin pharmacokinetics in lymphoma patients treated with doxorubicin-loaded eythrocytes. Haematologica 2007;92:570–571. https://doi.org/10.3324/haematol.10770.
[16] Vuimo T.A., Kulikova E.V., Sinauridze E.I., Yurkevich A.M., Kravchenko S.K., Ataullakhanov F.I. Erythrocyte as a potential vehicle for mitoxantrone. In: New Research on Biotechnology in Biology and Medicine. (Egorov A.M., Zaikov G. Eds.) Nova Science Publishers, Inc.: New York, NY, USA, 2006; Chapter 9, pp. 87–95. ISBN: 1‐60021‐092‐9.
[17] Вуймо Т.А., Куликова Е.В., Синауридзе Е.И., Александрович Ю.Г., Лисовская И.Л., Юркевич А.М., Атауллаханов Ф.И. Создание новой лекарственной формы антрациклинового антибиотика митоксантрона путем включения его в эритроциты. Молекулярная медицина 2008; №2:37-43.
[18] Ataullakhanov F.I., Vitvitsky V.M., Kovaleva V.L., Mironova S.B. Rubomycin loaded erythrocytes in the treatment of mouse tumor P388. Adv. Exp. Med. Biol. 1992;326:209–212, doi:10.1007/978‐1‐4615‐3030‐5_26.
[19] Ataullakhanov F.I., Batasheva T.V., Bukhman V.M., Komarova S.V., Oreshkina T.D., Vitvitsky V.M. Treatment of Rausher virus induced murine erythroblastic leukemia with rubomycin loaded erythrocytes. Adv. Biosci. 1994;, 92: 177–183.
[20] Ataullakhanov F.I., Kulikova E.V., Vitvitsky V.M. Doxorubicin binding by human erythrocytes. Adv. Biosci. 1994; 92:163–168.
[21] Тихонова А.Г., Александрович Ю.Г., Вуймо Т.А., Синауридзе Е.И., Атауллаханов Ф.И. Эритроциты как носители антрациклиновых антибиотиков. Тер. Архив 2008; 80:91-94.
[22] Sinauridze E.I., Vuimo N.A., Kulikova E.V., Shmyrev I.I., Ataullakhanov F.I. A new drug form of blood coagulation factor IX: red blood cell-entrapped factor IX. Med. Sci. Monitor 2010; 16(10):PI16-26; No 881179.
[23] Godfrin Y., Horand F., Franco R., Dufour E., Kosenko E., Bax B.E., Banz A., Skorokhod O.A., Lanao J.M., Vitvitsky V., Sinauridze E., Bourgeaux V., Gunter K.C. Meeting highlights: international seminar on the red blood cells as vehicles for drugs. Expert Opin. Biol. Ther. 2012; 12(1):127-133. doi: 10.1517/14712598.2012.631909.
[24] Ф.И. Атауллаханов, В.М. Витвицкий, А.М. Жаботинский, А.В. Пичугин, Е.И. Синауридзе. Регистрация АТФ в эритроцитах с помощью введенной в клетки люциферазы. Известия Академии Наук СССР, сер. биологическая, 1989, 6, 813-821
[25] Исаев В.Г., Гармаева Т.Ц., Скороход А.А., Паровичникова Е.Н., Тюрина Н.Г., Кучер Н.А., Витвитский В.М., Атауллаханов Ф.И., Савченко В.Г. Иммобилизованные формы даунорубицина у пациентов с острой лейкемией. Тер Архив 1999, 71, 31-37.
[26] Ataullakhanov, F.I.; Isaev, V.G.; Kohno, A.V.; Kulikova, E.V.; Parovichnikova, E.N.; Savchenko, V.G.; Vitvitsky, V.M. Pharmacokinetics of doxorubicin in patients with lymphoproliferative disorders after infusion of doxorubicin‐loaded erythrocytes. In Erythrocytes as Drug Carriers in Medicine; Sprandel, U., Way, J.L., Eds.; Springer: Boston, MA, USA, 1997; pp. 137–142. ISBN 978‐1‐4899‐0044‐9.
[27] Alexandrovich YG, Kosenko EA, Sinauridze EI, Obydennyi SI, Kireev II, Ataullakhanov FI, et al. Rapid Elimination of Blood Alcohol Using Erythrocytes: Mathematical Modeling and In Vitro Study. Biomed Res Int 2017;2017:1–14. https://doi.org/10.1155/2017/5849593.
[28] Protasov ES, Borsakova D V., Alexandrovich YG, Korotkov A V., Kosenko EA, Butylin AA, et al. Erythrocytes as bioreactors to decrease excess ammonium concentration in blood. Sci Rep 2019;9:1455. https://doi.org/10.1038/s41598-018-37828-5.
[29] Borsakova D V., Koleva LD, Protasov ES, Ataullakhanov FI, Sinauridze EI. Ammonium removal by erythrocyte-bioreactors based on glutamate dehydrogenase from Proteus sp. jointly with porcine heart alanine aminotransferase. Sci Rep 2022;12. https://doi.org/10.1038/s41598-022-09435-y.
[30] Атауллаханов Ф.И., Зейналов А.М., Синауридзе Е.И., Колева Л. Способ включения в эритроциты биологически активных компонентов методом проточного гипоосмотического диализа. Патент РФ № 2 791 817, патентообладатель ООО «РБК-Фармэко» Москва, РФ (2023). (Дата публикации 13.03.2023, Бюлл. №8).
[31] Атауллаханов Ф.И., Борсакова Д.В., Бовт Е.А., Даниелян А.Д., Зейналов А.М., Колева Л.Д., Кушнир Н.С., Протасов Е.С., Синауридзе Е.И., Суворова А.С. Устройство для включения биологически активных компонентов в эритроциты способом проточного диализа. Патент РФ № 2 772 209, патентообладатель ООО «РБК-Фармэко» Москва, РФ (2022). (Дата публикации 18.05.2022, Бюлл. №14).
[32] Protasov E, Koleva L, Bovt E, Ataullakhanov FI, Sinauridze E. Theoretical Analysis of the Built-in Metabolic Pathway Effect on the Metabolism of Erythrocyte-Bioreactors That Neutralize Ammonium. Metabolites 2021;11:36. https://doi.org/10.3390/metabo11010036.
[33] Protasov E, Martinov M, Sinauridze E, Vitvitsky V, Ataullakhanov F. Prediction of Oscillations in Glycolysis in Ethanol-Consuming Erythrocyte-Bioreactors. Int J Mol Sci 2023;24:10124. https://doi.org/10.3390/ijms241210124.
[34] Forconi, S.; and Guerrini, M. Do hemorheological laboratory assays have any clinical relevance? Clin. Hemorheol. Microcircul. 1996, 16(1), 17-22. DOI: 10.3233/CH-1996-16104.
[35] Pieragalli, D.; Acciavatti, A.; Galigani, C.; Messa, G.L.; Blardi, P.; Guerrini, M.; Forconi, S.; and Di Perri, T. Interrelationship between whole blood and washed red cell filterability. Clin. Hemorheol. Microcircul. 1987, 7(2), 273–276. DOI: 10.3233/CH-1987-7212.
[36] Reid, H.L.; Barnes, A.J.; Lock, P.J.; Dormandy, J.A.; and Dormandy, T.L. A simple method for measuring erythrocyte deformability. J. Clin. Path. 1976, 29 (9), 855-858. DOI: 10.1136/jcp.29.9.855.
[37] Атауллаханов, Ф.И., Витвицкий, В.М., Костына, М.А., Лисовская ИЛ. Способ определения деформируемости эритроцитов и устройство для его осуществления. 2052194, 1991.
[38] Libiad M, Yadav PK, Vitvitsky V, Martinov M, Banerjee R. Organization of the Human Mitochondrial Hydrogen Sulfide Oxidation Pathway. J Biol Chem 2014;289:30901–10. https://doi.org/10.1074/jbc.M114.602664.
[39] Yadav PK, Martinov M, Vitvitsky V, Seravalli J, Wedmann R, Filipovic MR, et al. Biosynthesis and Reactivity of Cysteine Persulfides in Signaling. J Am Chem Soc 2016;138:289–99. https://doi.org/10.1021/jacs.5b10494.
[40] Hanna DA, Vitvitsky V, Banerjee R. A growth chamber for chronic exposure of mammalian cells to H2S. Anal Biochem 2023;673:115191. https://doi.org/10.1016/j.ab.2023.115191.